L’amendement qui modifie les Règlements (UE) 2017/745 et (UE) 2017/746 en ce qui concerne les dispositions transitoires relatives à certains dispositifs médicaux (DM) et à certains dispositifs médicaux de diagnostic in vitro (DMDIV) vient d’être adopté par le Parlement européen.
Cet amendement a été initié dans une volonté commune entre le Parlement européen, les États membres et les parties prenantes (professionnels de la santé, patients, monde universitaire, organismes scientifiques, industrie et organismes notifiés). Il répond à un constat unanime d’un risque de pénurie de dispositifs médicaux qui mettrait en péril la sécurité des patients et d’un frein à l’innovation en matière de santé dans l’UE. Cette situation est exacerbée par les effets de la pandémie de COVID-19 sur les investigations cliniques, les audits sur site et les chaînes d’approvisionnement mondiales.
L’amendement prévoit la prolongation de la période de transition par une prorogation de la validité des certificats délivrés au titre des directives.
Cette approche vise à trouver un équilibre entre la capacité disponible des organismes notifiés et le niveau de préparation des fabricants, tout en assurant une haute protection de la santé publique.
Néanmoins, il est important de souligner que les dispositions prises dans ce texte ne vous prémunissent pas d’entamer dès à présent certaines actions relatives à votre transition vers les nouveaux règlements. En effet, cette prolongation ne doit pas être considérée comme un temps supplémentaire au risque de provoquer un nouveau goulet d’étranglement aux prochaines échéances.
Pour vous permettre de comprendre les tenants et les aboutissants de ce nouveau texte, GMED a analysé les différents paragraphes clés et l’impact pour les fabricants et les organismes notifiés.
Dispositions introduites
L’amendement modifie les dispositions transitoires et concerne uniquement les dispositifs pour lesquels l’intervention d’un organisme notifié sous règlement est nécessaire. Il permet aux fabricants qui se sont engagés ou qui vont s’engager avant le 26/05/2024 dans un processus d’évaluation de la conformité au titre du Règlement (UE) 2017/745 (RDM) pour leurs dispositifs médicaux, de poursuivre la mise sur le marché de leurs dispositifs médicaux sous certaines conditions (« legacy devices »). Les Institutions de l’Europe s’assurent par ces dispositions que seuls les dispositifs qui ont pour but d’être conformes ou d’être substitués par des dispositifs conformes au Règlement (UE) 2017/745 soient mis sur le marché après le 26/05/2024. Le texte entre en vigueur le jour de sa publication au Journal Officiel de l’Union Européenne.
L’amendement permet aux fabricants de mettre de nouveau sur le marché les dispositifs dont le certificat au titre de la directive relative aux dispositifs médicaux ou dispositifs médicaux implantables actifs est expiré lorsqu’une demande formelle de certification au titre du RDM a été déposée et le contrat de certification avec l’ON désigné pour le règlement a été signé avant l’expiration dudit certificat.
Modification du calendrier
Le calendrier est défini comme suit, en fonction de la classification des dispositifs selon le RDM :
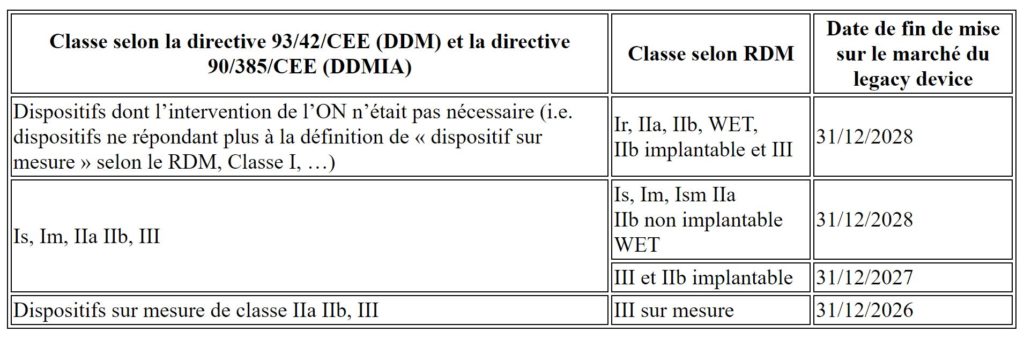
Retrait de la date limite de mise à disposition/mise en service
L’amendement supprime la date après laquelle les dispositifs ne peuvent plus être mis à disposition (date de vente limite). Les legacy devices pourront donc continuer d’être mis à disposition et mis en service après le 26/05/2025.
Cette suppression s’applique de manière inconditionnelle : les dispositifs qui ne seront pas mis en conformité au règlement DM en sont également bénéficiaires.
Par ailleurs, cette disposition s’applique également aux dispositifs médicaux de diagnostic in vitro mis sur le marché avant le 26 mai 2022 ou mis sur le marché au titre de l’article 110.3 du Règlement (UE) 2017/746.
Gestion des certificats
Aucune disposition de l’amendement ne prévoit la réémission ou la modification des certificats émis au titre des Directives. Les certificats sont réputés étendus de fait, à la seule condition qu’ils n’aient pas été retirés.
Conditions pour bénéficier des dispositions transitoires
La prolongation de la période pendant laquelle les dispositifs peuvent être mis sur le marché est assortie de conditions.
Pour en bénéficier, le fabricant doit :
- mettre en place et maintenir un Système de Gestion de la Qualité conforme aux exigences de l’Article 10, paragraphe 9 du RDM avant le 26/05/2024 ;
- avant le 26 mai 2024, avoir déposé sa demande formelle de certification pour chaque dispositif auprès d’un Organisme Notifié désigné au titre du RDM et avoir signé un contrat avec ledit Organisme Notifié couvrant les dispositifs concernés avant le 26/09/2024.
En sus, les dispositifs :
- doivent rester conformes aux exigences de la Directive DM ou DMIA qui leur sont applicables ;
- ne doivent pas faire l’objet de changement significatif de conception ou de destination ;
- ne doivent pas présenter de risque inacceptable pour la santé du patient, de l’utilisateur ou de toute autre personne, ou pour d’autres aspects de la protection de la santé publique ;
Note : Pour les dispositifs de classe III implantables sur mesure, le fabricant doit :
- assurer la conformité de son DM avec toutes les exigences du Règlement (UE) 2017/745 applicables aux dispositifs sur mesure, à l’exception de l’obtention d’un certificat UE de conformité émis au titre du règlement ;
- avoir déposé sa demande formelle de certification auprès d’un Organisme Notifié désigné au titre du RDM avant le 26/05/2024 ;
- avoir signé un contrat avec un Organisme Notifié désigné au titre du RDM avant le 26/09/2024.
Les dispositifs médicaux ayant été retirés des certificats directive DM et directive DMIA ne peuvent pas bénéficier de ces nouvelles dispositions de transition.
GMED rappelle qu’il est de la responsabilité du fabricant de s’assurer que chaque legacy device mis sur le marché est conforme aux dispositions de l’article 120.3.
Il est à noter que le dépôt de demande formelle et la signature de contrat auprès d’un Organisme d’évaluation de la conformité en cours de désignation au titre du Règlement ne permet pas aux fabricants de bénéficier des dispositions transitoires.
Surveillance des legacy devices
Avant le 26 septembre 2024, la surveillance des legacy devices est sous la responsabilité de l’Organisme Notifié qui a émis le certificat au titre de la Directive applicable, sauf si le fabricant a convenu avec l’ON désigné au titre du RDM avec lequel il a signé un contrat au titre du RDM que ce dernier s’engage à effectuer la surveillance.
A partir du 26 septembre 2024, l’ON avec lequel le fabricant a signé un contrat au titre du RDM est responsable de la surveillance des legacy devices couverts par la demande de certification et le contrat RDM.
Dans les deux cas, les dispositions pour le transfert de la surveillance doivent être définies dans un contrat entre le fabricant et l’ON avec lequel le fabricant a introduit sa demande de certification RDM, dans la mesure du possible, avec l’ON ayant émis le certificat au titre de la directive.
Si votre certificat directive est arrivé à échéance avant l’entrée en vigueur de l’amendement et
- vous avez signé un contrat en application du RDM avant sa date d’expiration ou
- si vous bénéficiez d’une autorisation de poursuivre la mise sur le marché délivrée au titre de l’article 59 ou 97.1 du RDM,
nous vous invitons à vous rapprocher de GMED afin que les dispositions contractuelles définissant les modalités de surveillance de vos legacy devices soient établies.
Conclusion
Comme nous avons pu le voir, les modifications apportées visent à maintenir la disponibilité sur le marché européen d’un large éventail de dispositifs médicaux tout en assurant la transition progressive vers le nouveau cadre.
Nous tenons cependant à rappeler que, malgré ce report, nous encourageons fortement les fabricants à poursuivre leurs efforts de transition afin d’éviter, aux prochaines échéances, le risque d’un déséquilibre entre la capacité disponible des organismes notifiés et les demandes de certification.
GMED, en tant qu’Organisme Notifié, s’engage auprès de l’industrie des dispositifs médicaux dans l’effort de certification des legacy devices. Pour ce faire, nous vous invitons à contacter dès à présent les équipes de GMED afin de connaître les solutions mises en œuvre relative aux dispositions transitoires : sales@lne-gmed.com
PARTAGER
Événements
Pour répondre aux enjeux auxquels vous êtes confrontés, prenez connaissance des prochains événements : formations, webinars, forums…
